¿Qué es la epigenética?
La epigenética estudia cambios en la expresión de ADN, es decir, la activación y desactivación de los genes mediante modificaciones químicas provocadas en respuesta a los factores ambientales (Casavilca et al., 2019; Al Aboud et al., 2023). Estas modificaciones pueden heredarse durante la replicación celular e incluso a través de generaciones, aunque también pueden modificarse por el estilo de vida (NHI, 2025a). Hay que tener en cuenta que la epigenética no es el estudio de MUTACIONES, ya que no implica cambios en la secuencia de nucleótidos del ADN.
¿Cómo se activa y desactiva la expresión génica?
Los genes se activan y desactivan mediante un mecanismo de regulación génica. Estas señales provienen de factores externos o internos que activan o inhiben proteínas llamadas factores de transcripción (Alberts et al., 2002). Esta regulación es esencial, ya que todas las células del cuerpo humano poseen el mismo ADN, pero, gracias a estos mecanismos, células hepáticas y neuronales adquieren funciones completamente distintas.
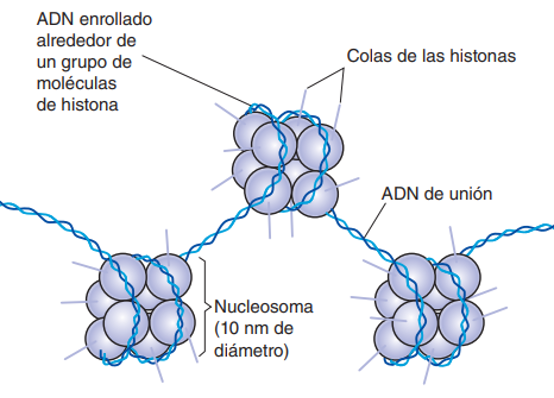
El ADN se encuentra en el núcleo de nuestras células, compactado en cromosomas. Estos están formados por nucleosomas, que a su vez están compuestas por ocho proteínas denominadas histonas. Estas proteínas actúan como andamios estructurales del ADN, debido a su carga positiva, dada por la abundancia de aminoácidos de cadenas laterales básicas. Por su parte, el ADN presenta cargas negativas debido a los grupos fosfatos (Solomon et al., 2013). (Figura 1).
Para que los genes puedan ser expresados es necesario que el cromosoma libere tensión y permita que los factores de transcripción realicen su trabajo, pero ¿cuáles son los mecanismos que permiten liberar esta tensión estructural? Uno de los varios mecanismos para cambiar la estructura de la cromatina es la modificación de las colas de las histonas, mediada por los grupos metilo, acetilo, azúcares e incluso por proteínas que reaccionan químicamente con la cola de las histonas para ocultar o mostrar genes (Solomon et al., 2013).
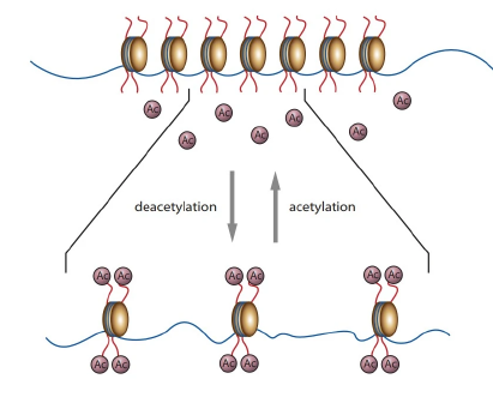
La modificación de las histonas es un objetivo de intensa investigación para ofrecer nuevos métodos para tratar el cáncer y otras enfermedades. Para que los genes puedan expresarse, los biólogos encontraron una relación entre ciertos grupos químicos (el grupo acetilo y metilo) que se encuentra presente en las colas de las histonas, principalmente en los residuos de lisina, lo cual permite la expresión de los genes (Solomon et al., 2013). La acetilación de las colas N-terminales de las histonas es un proceso reversible y frecuente, mediado por la enzima acetiltransferasa. Esta enzima neutraliza las cargas positivas del grupo β-amino (la liberación de estas cargas va a depender mucho del pH fisiológico), lo que facilita la relajación de la cromatina y permite el acceso a los factores de transcripción (Armstrong, 2014). Figura 2.
Del conjunto de las 8 histonas, la histona que nos interesa para comprender la herencia epigenética es la histona 3 “H3”. H3 presenta varios residuos de lisina “K” en las posiciones: 4, 9, 14, 23, 27, 45, 36 y 79. Se conoce que estas lisinas experimentan la acetilación y algunas la metilación, pero ¿cuál es la relevancia biológica de la acetilación y metilación en H3? Estudios recientes han determinado que H3K9 se encuentra en la cromatina transcrita cuando está acetilada, pero cuando está metilada se produce una represión genética, es decir, que no se transcribe (Armstrong, 2014). Existen 3 tipos de metilación en la lisina: monometilo, dimetilo y trimetilo. Estos múltiples estados de metilación afectan a la respuesta transcripcional.
Ya hablamos sobre la activación y desactivación de la expresión génica, pero ¿qué es la represión génica?
El cuerpo humano tiene alrededor de 20.000 a 25.000 genes codificables, pero esto solo representa el 1 % de todo el genoma. Hace años, algunos autores consideraban que el “ADN no codificante era basura”. Sin embargo, investigaciones recientes han demostrado que gran parte del genoma no codificante tiene un papel muy importante. Este consiste en proteger, dar soporte, suprimir genes y generar diferenciación celular. Incluso variantes en el ADN no codificante pueden generar enfermedades, como ciertos cánceres, aunque esto sigue en estudio (Litwack, 2021; Ramón y Cajal & Hümmer, 2018).
Podría suponerse que los 25.000 genes están activos al mismo momento, pero no, estos genes se encuentran reprimidos genéticamente “represión génica”, esta represión ocurre por procesos químicos, denominados metilación del ADN o en las Histonas, sobre este último se hablará más adelante. Una analogía útil para comprender este proceso consiste en imaginar que el ADN es un libro de recetas, nosotros somos las proteínas que leen y preparan dicha receta. Si el libro se encuentra normal y sin ninguna nota, continuaremos con la receta, pero, si el libro se encuentra con alguna nota que bloquee la lectura, para nosotros será imposible realizar la receta. A esto se le conoce como represión génica, y consiste en el bloqueo de la lectura del ADN, lo que impide la síntesis de proteínas.
¿Cuáles son los factores epigenéticos heredables?
Ahora que conocemos un poco sobre la epigenética y cómo esta se expresa o reprime genes por las reacciones de acetilación y metilación en los sitios N-terminal de las histonas que poseen lisinas. ¿cómo se heredan estos factores epigenéticos?, En la formación de los óvulos y
espermatozoides, gran parte de las marcas epigenéticas de nuestros progenitores se borran, pero existen ciertas excepciones, donde, dichas marcas no son eliminadas, incluso se llegan a marcar genes para suprimirlos. Esto es conocido como impronta genética, y es cuando uno de los dos alelos otorgados por nuestros padres se expresa y el otro se suprime. Este proceso no debe confundirse con las mutaciones genómicas que afectan la expresión normal de los genes. Estas marcas epigenéticas impresas en los genes llegan a persistir durante toda la vida (Solomon et al., 2013; NHI, 2025b).
El estudio realizado por Cheedipudi et al., (2014). Epigenetic inheritance of cell fates during embryonic developments, destaca que la herencia epigenética está dada por la metilación de H3K9, H3K4 y H3K27, estas dos últimas se cree que generan marcas epigenéticas opuestas, H3K27me3 silencia genes claves del linaje y H3K4me3 los prepara para su activación.
Aunque hablemos de que la herencia epigenética está dada por H3 y las K4, K9 & K27, no son los únicos factores que participan en la herencia epigenética ya que existen otros factores como lo menciona Hamilton, (2011). Estos son los miRNA, metilación del ADN, hipometilación, hipermetilación, proteínas que remodelan la cromatina, etc.
El ejemplo más claro de la herencia epigenética a nivel mundial ocurrió entre 1944 y 1945 durante el invierno holandés. Hay que recordar que para esta época se estaba liberando la segunda guerra mundial y los alimentos para esa época y situación eran poco accesibles, durante este evento se identificó que los niños nacidos presentaban alteraciones en la metilación del gen IGF2 (insulin-like Growth Factor 2), los progenitores que fueron expuestos a estas hambrunas y luego tuvieron hijos durante las primeras semanas de gestación mostraron niveles extremadamente bajos en la metilación del gen IGF2.
IGF2 ubicado en el cromosoma 11p15.5 se encuentra en una región rica de genes improntados, genes heredados por nuestros padres, pero se expresan de diferente manera si fueron heredados por parte del padre o de la madre, por lo general, ambos genes deberían expresarse, pero en la impronta genética, solo uno de los alelos es expresado), El gen IGF2 del padre debe estar activo, mientras que el gen de la madre debe estar inactivo. Durante el proceso de gestación se activó el gen de la madre, lo que provocó que los niños nacidos en aquella época presentaran bajos niveles de metilación en el gen IGF2, incluso seis décadas después. La función de IGF2 es la de una hormona de crecimiento fetal y desarrollo temprano.
Aunque la hipometilación del gen IGF2 no causó efectos inmediatos visibles, sí se observó una mayor predisposición a enfermedades como diabetes tipo 2, obesidad y afecciones
cardiovasculares. Dependiendo del estilo de vida de cada persona. Este hallazgo constituyó una de las primeras evidencias que demostraron que los factores ambientales a edades tempranas pueden generar marcas epigenéticas heredables por décadas (Heijmans et al., 2008). En el mismo estudio se expone los índices de expresión del gen IGF2 de 60 personas que se vieron afectadas por el invierno holandés y como grupo control se usaron a sus hermanos de edad similar, del mismo sexo, pero ellos no vivieron esta hambruna en el periodo de gestación. Los índices de expresión del gen IGF2 de los hermanos sanos fue de 0.515 y el índice de expresión del mismo gen para las personas con hipometilación fue de 0.488, el estudio de estos resultados fue método cuantitativo basado en espectrometría de masas.
¿Podemos eliminar la herencia epigenética?
Recapitulando, la epigenética se refiere al estudio de los mecanismos que regulan la expresión génica, los cuales pueden estar mediados por la acetilación y la metilación de la histona H3 y los residuos de lisina K4, K9 y K27, la herencia epigenética puede darse por factores externos como la hambruna ocurrida en el invierno holandés, estrés, dieta, etc., y es heredable, pero ¿hasta qué punto se transmiten las modificaciones epigenéticas entre generaciones? La respuesta que han dado las investigaciones es que esta herencia puede llegar a durar hasta dos generaciones. No obstante, hay que recordar lo mencionado por National Human Genome Research Institute (NHI, 2025b), gran parte de estas marcas epigenéticas se borran durante la formación de los óvulos y los espermatozoides, pero algunas llegan a persistir toda la vida.


